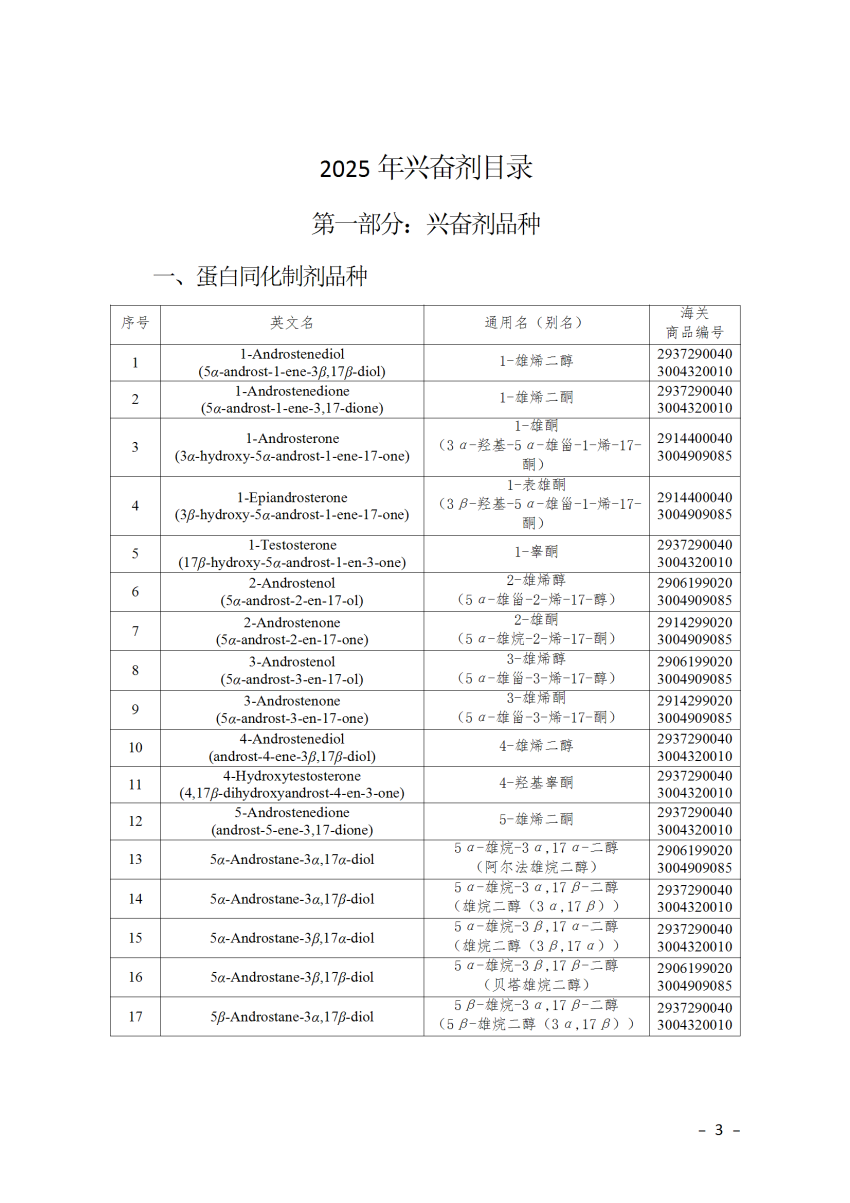
2025年兴奋剂目录
...
国家药监局批准中药创新药复方比那甫西颗粒上市
近日,国家药品监督管理局批准了新疆银朵兰药业股份有限公司申报的中药1.1类创新药复方比那甫西颗粒上市。 该药品为按照维吾尔医药理论组方的复方制剂,开展了随机、双盲、安慰剂平行对照的多中心临床试验,具有清除体内异常体液质的功效,用于热性感冒,症见发热、鼻塞、流涕、咽痛、头痛、口干等。该药品为普通感冒中维医辨证属于热性感冒的人群提供新的用药...
从实验室到临床:如何突破溶解度瓶颈实现药物高效递送?
在创新药研发的漫长征程中,溶解度是贯穿分子设计、制剂开发到临床转化的核心指标。它不仅决定药物的吸收效率和生物利用度,更直接影响着治疗窗口的宽度与患者安全性。本文从跨学科视角解析溶解度优化的关键策略及其对药物研发的全局影响。一、溶解度与药物递送效率的动态博弈 根据生物药剂学分类系统(BCS),药物需在胃肠道250 mL...
从获批到弃疗仅一年!辉瑞Beqvez为何成最短命天价药?
近日,辉瑞宣布终止B型血友病基因疗法Beqvez的全球开发和商业化。这款疗法自2024年4月获FDA批准后仅一年便黯然退场,其定价高达350万美元,但上市后未实现任何商业销售。Beqvez通过AAV载体导入凝血因子IX基因,旨在一次性解决患者长期出血问题,但因定价过高、市场接受度低及竞争压力未能打开局面。背后原因多重:市场遇冷:辉瑞透露,...
奋斗并肩 荣耀共享 | 泰科迈医药2024年度总结表彰暨2025迎新年会
在这个充满希望与活力的时刻,泰科迈医药迎新年会拉开帷幕,这是一场充满欢乐与感动的盛会,让我们欢聚一堂,一起迎接蛇年的到来......01回顾2024首先,一段精心策划的回顾视频开启了年会的序幕,它以生动的影像和音乐,引领我们回顾了2024年的精彩瞬间。在这一年里,我们共同经历了许多难忘的时刻:从项目的顺利启动,到面对困难时的齐心协力,再到...
仿制药参比制剂目录(第八十九批)
...
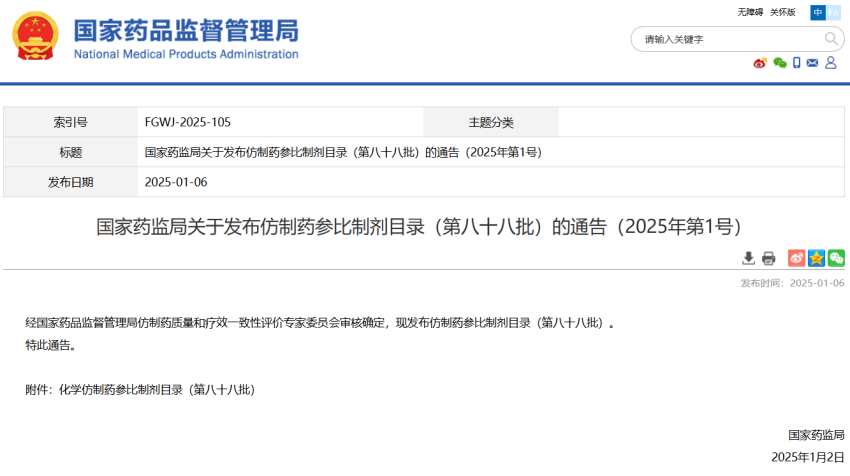
仿制药参比制剂目录(第八十八批)
...
2025年 涉及药品批文的关键政策整理
2016年2月6日,国务院办公厅发布了《关于开展仿制药质量和疗效一致性评价的意见》(国办发〔2016〕8号),规定在化学药品新注册分类实施前批准上市的仿制药,自首家品种通过一致性评价起,其他生产企业的相同品种需在3年内完成一致性评价;若未按时完成,则不再注册。2023年9月25日,CDE发布了《仿制药质量和疗效一致性评价受理审查指南(征求...
国家药监局发布仿制药参比制剂目录(第八十七批)
国家药监局发布仿制药参比制剂目录(第八十七批)...