脂肪乳专题(一)
脂质体, 又称之为脂小球, 是由磷脂双层膜构成的中空小球。构成脂质体 的主要成分是磷脂和其他类脂化合物。早在1961年英国学者Bangham和Standish就发现当磷脂分子分散在水中时会自然形成有序排列的类似生物膜结构的多层囊泡 。囊泡的每一脂质层均以有序排列的磷脂双分子构成囊泡中央和各层之间被水相隔开。后来人们将这种具有双层膜形态的类似生 物膜结构的中空小球通称为脂质体。近年来随着生物技术的发展, 人们已有能力设计, 并通过一定的过程制备各种不同的脂质体药物转运系统, 包括立 体化学性质稳定的脂质体、长循环脂质体、靶向脂质体、酸敏脂质体、 磁敏和热敏脂质体。脂质体的制备工艺也更加完善,其优点充分得以体现, 脂质 体的研究愈来愈受到重视,且发展迅速。脂质体技术的诱人市场前景和良好 的技术性能使其已经渗透到制药、生物技术、免疫调节、遗传工程、基因药物等各个领域, 脂质体在其他领域的应用 也备受青睐。本文主要从药物制剂的角度综合讨论,以期对脂质体研究感兴趣的同行有所助益。
脂质体的构成和分类
脂质体是以磷脂和其他两性化合物分散在水中时形成的有序排列的囊泡结构。脂质体的性质和粒径依其制备方法, 所用材料以及组成的不同而差异大。在讨论中笔者通常按其结构所包含的双层磷脂膜层数、电荷性质、功能及用途等来对脂质体加以分类。笔者在阅读参考资料时会接触到很多不同的脂质体分类法。这些分类法 由于着眼点不同往往强调了脂质体某一方面的特性, 有着各自的优缺点, 在阅读参考文献时应该有所注意
按脂质体的形状和粒径分类
可以按其形状和粒径分类。不同的制备方法会形成形状和粒径差异很大的脂质体。脂质体可以制备的非常小, 也可以非常大。它们可以包含多层磷脂双层膜,也可以仅含单层磷脂双层膜。 由于脂质体的粒径对其制剂性质和应用影响很大, 故按其形状和粒径分类是目前最常用的分类方法
多室脂质体
含有多层磷脂双层膜的脂质体称为多室脂质体, 其粒径多为400-5000nm。一般来说多室脂质体含层以上的磷脂双层膜。含 3-5层磷脂双层膜的脂质体称为复层脂质体。为了方便, 很多时候人们把复层和多室脂质体统称为多室脂质体
小单室脂质体
由一层磷脂双层膜所构成的脂质体。小单室脂质体的粒径小于50nm。随着脂质体的粒径递减, 其球体弧度增加, 随之造成磷脂双层膜内外膜的不对称。这种内外膜的不对称性在小单室脂质体中表现得尤其突出。比如 25nm小单室脂质体(磷脂双层膜的厚度为4-5nm)它的外层膜占用了70%磷脂。 内外膜的不对称性使得小单室脂质体的球面有很大的张力。所以相对于大单室脂质体来说, 小单室脂质体不稳定, 易于融合
大单室脂质体
由一层磷脂双层膜所构成的脂质体。其与小单室脂质体的区别仅在于粒径的大小不同。大单室脂质体的粒径一般在80-200nm左右。其在血液中的长时效、高载药量及稳定性, 决定了大单室脂质体是理想的静脉给药药物载体。目前已上市的脂质体药物多数是大单室脂质体
按表面电荷性质分类
中性脂质体
主要由卵磷脂、不带电荷的磷脂以及其他不带 电荷的类脂化合物构成的脂质体
负电性脂质体
就脂质体整体而言, 呈负电性。其磷脂组份中含有部分带负电荷的磷脂, 如磷脂酞丝胺酸、磷脂酞肌醇 以及磷脂酞甘油脂
正电性脂质体
脂质体呈正电性。其磷脂组份中含有部分带正电荷的化合物, 如二-十八烷-二-甲 基胺盐、十八氨。近年来正电性脂质体作为非病毒基因药物的载体受到了广泛的关注
按功能分类
普通脂质体
包括上述单室脂质体、 多室脂质体和多相脂质体等
长效脂质体
解决了普通脂质体易从体循环中被肝、脾巨噬细胞迅速清除的缺点, 可以使脂质体在血液中保留较长一段时间。 其表面多以聚乙二醇、甲基聚哇琳及聚乙烯毗加以修饰
智能脂质体
针对某些身体内外特殊理化性质而构造的脂质体。这类脂质体随外界条件的变化而变化。可以定时、定点、定量地释放药物。包括了热敏、酸敏、光敏、磁敏、可控释放及靶向给药
按脂质体发展史断代分类
这一分类法主要侧重于脂质体作为给药载体的发展历史及重要的带有突破性的脂质体功能改进指标而言表, 很难有一个公认的统一说法
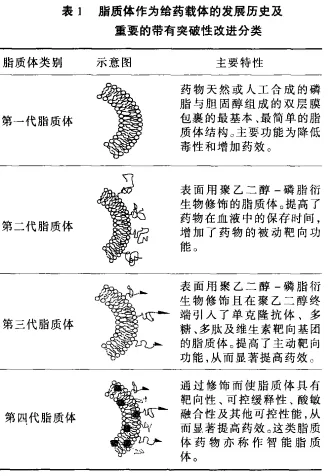
第一代脂质体
天然或人工合成的磷脂与胆固醇组成的双层膜包裹的最基本、最简单的脂质体结构。主要功能为降低毒性和增加药效。已生产上市的脂质体药物多属此类, 比如脂质体两性霉素、脂质体阿霉素及脂质体柔红霉素
第二代脂质体
表面用聚乙二醇-磷脂衍生物修饰的脂质体。修饰后的脂质体提高了药物在血液中的保存时间, 增加了药物的被动靶向功能。聚乙二醇-脂质体阿霉素已经生产上市, 多种聚乙二醇-脂质体药物也已进入临床Ⅱ/Ⅲ期实验
第三代脂质体
表面用聚乙二醇-磷脂衍生物修饰且在聚乙二醇终端引入靶向基团的脂质体。提高了主动靶向功能, 从而显著提高药效。这些靶向基团可以是单克隆抗体、多糖、多肽及维生素。这类脂质体药物也已进入临床Ⅰ/Ⅱ期实验
第四代脂质体
通过修饰而使脂质体具有靶向性、可控缓释性、酸敏融合性及其他可控性能, 从而显著提高药效。这类脂质体药物具有一定的可控性,亦称作智能脂质体。第四代脂质体还处于实验室研究阶段
脂质体药物的制备方法
脂虽然脂质体的制备可以细分为薄膜分散法、逆相蒸发法及有机溶剂注入法等许多种, 但从所要装载的药物性质的不同以及脂质体药物制剂大规模工业生产的角度可以分为5种
混溶法
醋溶性药物可以与不同组份的磷脂混合, 然后制备成脂质体药物制剂, 这样醋溶性药物就可以被包埋在脂质体双层膜中。这种方法操作简便, 生产工艺要求低, 紫杉醇、两性霉素脂质体药物即以此法制备而成。这种脂质体制剂的载药量和药物在脂质体膜中的亲和力完全取决于药物和磷脂间的相互作用。一般来说, 这类制剂的 药物包封率很高,几乎100%。由于受药物在磷脂中溶解度的限制, 单位重量的磷脂的载药量不可能太高
PH梯度法
由于其包埋效率高, 包埋后生成 的脂质体制剂不需 清除外部游离药物, 是较成功的脂质体药物制备方法之一。硫酸铵以及其他离子梯度法的最基本原理也可以追踪到pH梯度, 所以不专门加以论述。pH梯度或离子梯度法仅适用于弱碱弱酸性药物。对于弱碱性合成药物如抗癌药物阿霉素和长春新碱, 可以有效地用梯度包埋法。制备脂质体时, 选用适当的缓冲液, 使脂质体囊泡内部处于pH=4.0。然后将药物和脂质体混合并将外部的pH调到7.5, 从而形成脂质体囊泡内外大约为3-3.5 个单位的pH梯度, 此条件下弱碱性合成药物通过Henderson-Hasselbach 平衡重新分布于囊泡中。以阿霉素为例, 试验证明, 在脂质体的脂质的相变温度时, 99%的阿霉素包埋入脂质体中。由于其包埋效率高,包埋后生成的脂质体药物不需清除外部游离药物
被动包埋法
多数水溶性药物都可以用被动包埋法包埋在脂质体囊泡内而形成脂质体药物。磷脂分散在含有药物的溶液中时, 在脂质体囊泡形成的同时可以把一定量的药物包裹在脂质体囊泡中。这种方法操作简便, 适合于水溶性药物, 生产工艺要求低。其缺点是由于药物包埋效率低(大单室脂质体的包埋效率<10%)需要分离脂质体外部的游离药物。很显然这种方法不适用包裹价格非常昂贵的药物
嵌入法
同时含有亲水和亲油片段的药物, 如膜蛋白、膜多糖、多肤药物的磷脂化合物及抗原蛋白或多肤的磷脂偶合物, 都可以利用此方法将药物嵌入脂质体膜, 形成脂质体药物制剂。将药物和脂质体混合在一起, 药物的亲油片段会嵌入脂质体双层膜中。药物嵌入的快慢和多少取决于脂质体的磷脂组成、药物的最小乳化浓度值、药物的亲油片段与磷脂的亲合度及混合液的温度等。一般而论, 嵌入的药物很难高于90%。未嵌入脂质体的药物可以用凝胶色谱柱或层析柱加以分离。特别要指出的是, 抗原蛋白、多肽或多糖的磷脂偶合物嵌入脂质体后, 其抗原活性显著提高,免疫记忆明显延长, 嵌入法制备脂质体疫苗有重要的临床意义
乳化分散法
乳化分散法是迄今已知脂质体药物制备方法中条件最温和的一种。由于该方法既没有使用有机溶剂, 也没有足以破坏大分子生物活性的苛刻条件, 避免了药物的失活和降解, 还可提高药物的包封率,非常适宜于制备脂质体蛋白、反义核酸和基因药物。该方法的基本原理是:先将磷脂和药物用表面活性剂分散在水中, 然后利用透析、超滤等办法将表面活性剂除去。药物包埋率的高低受多方面因素影响和控制。最主要的有表面活性剂的选择, 特别要注意表面活性剂的最小成胶束浓度(CMC值最好在5-25之间);磷脂的选择和搭配, 如果被包裹的是负电荷药物,磷脂配方中应该有正电荷磷脂, 如果被包裹的是正电荷药物, 应选用负电荷磷脂;溶液的酸度以及离子浓度也对药物的包封率有一定的影响
结语随着制备技术的持续成熟与丰富,脂质体的制备已变得更为完善和高效。然而,技术进步仅仅是第一步,更为关键的问题在于如何使这些技术与实际需求精准匹配。毕竟,每种药物都具备其独特的性质和递送要求,而脂质体的类型和制备方法也丰富多样。因此,脂质体制备技术的选择并非固定不变,而是需要依据药物的具体特性“量体裁衣”。只有深入了解药物的理化性质、靶向需求以及预期的治疗效果,我们才能从众多的脂质体类型和制备方法中,挑选出最为合适的一种,进而实现药物递送的最佳效果。


我要评论